- 比原计划提前一个月在中美两国同步启动临床试验
- HR+/HER2-在乳腺癌患者中占比最大,肿瘤耐药以后的治疗选择是亟待解决的难点之一
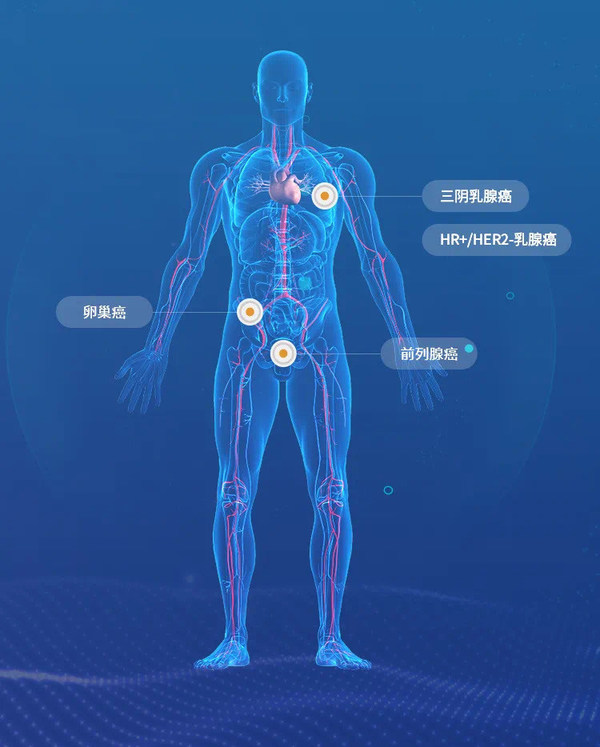
- Afuresertib新药临床试验已覆盖4个癌种
中国上海和美国新泽西2021年8月25日 /美通社/ — 来凯医药宣布,继6月19日获得美国食品和药物管理局(FDA)临床批件之后,中国国家药品监督管理局(CDE)也于8月17日批准了来凯医药该项新的临床试验:处于临床开发阶段的1类候选新药afuresertib(LAE002)联合抗雌激素药物氟维司群,在标准治疗失败的局部晚期或转移性在激素受体阳性/人表皮生长因子2受体阴性乳腺癌患者(下简称HR+/HER2-)的Ib/III期临床试验研究。
至此,这一全球多中心临床研究比原计划提前一个月在中美两国同步启动。此次快速批准也意味着:afuresertib联合氟维司群联合治疗在Ib期研究中获得了可靠的安全性数据后,可尽快展开3期全球注册研究。
Afuresertib新药临床试验覆盖4个癌种
Afuresertib(LAE002)是来凯医药从诺华公司引进全球独家权益、已有临床验证结果(Proof of Concept)的候选新药,属于新一代小分子泛AKT激酶强效抑制剂。
目前Afuresertib已在全球收获4个癌种的临床研究:覆盖了卵巢癌,前列腺癌、三阴乳腺癌,HR+/HER2-乳腺癌。
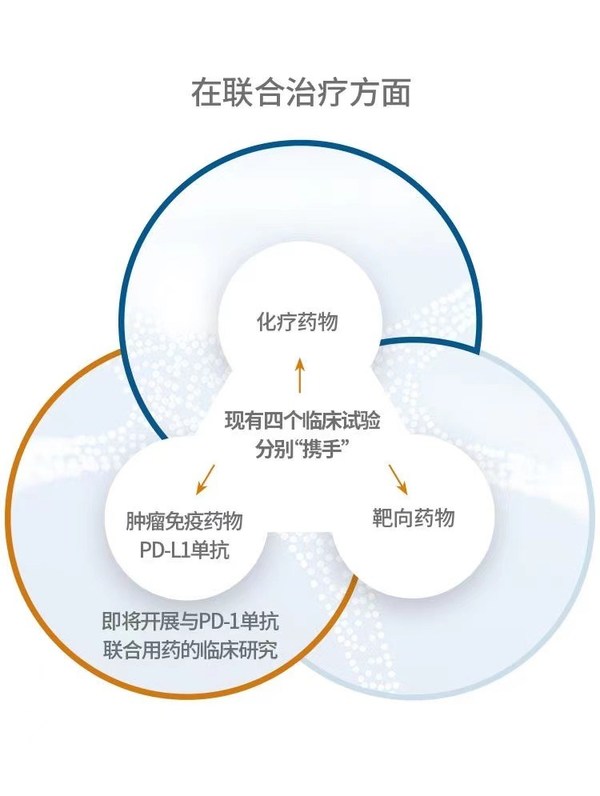
在联合治疗方面,现有四个临床试验分别“携手”化疗药物、靶向药物和肿瘤免疫药物PD-L1单抗, 下一步afuresertib还将开展与PD-1单抗联合用药的临床研究。
努力解决HR+/HER2-在乳腺癌耐药需求
乳腺癌是全球女性中最常见的癌症。在中国所有乳腺癌患者中,约62%属于HR+/HER2-[1],美国患者中这一类分子亚型比例高达68%[2]。
尽管大多数此类乳腺癌患者最初可从一/二线治疗的抗激素疗法及CDK4/6 抑制剂或者化疗中获益,但一段时间后,大部分肿瘤患者可能对上述治疗产生耐药。肿瘤耐药以后的治疗选择一直是乳腺癌各种临床研究致力解决的难点之一。
“HR+/HER2-在乳腺癌患者中占比最大,抗激素治疗及CDK4/6抑制剂耐药以后的治疗是目前最亟需解决的多种未满足的医疗需求之一。这也是显著提高乳腺癌患者治疗效果及改善生活质量的最关键一环。”来凯医药首席医学官岳勇博士表示:“女性是一个家庭的核心和希望,afuresertib多种联合治疗目前已在多种癌症耐药患者的临床试验中,初步显示出抗肿瘤疗效及良好的安全性,尤其是女性特有的卵巢癌和乳腺癌。我们期待这些联合治疗能够给患者带来新的希望,也让医生在面对这些难治的肿瘤耐药患者时有更多更好的选择。”
勇争AKT酶抑制剂全球赛道“金牌”
“此次临床批件比原计划提前一个月获批,充分显示了中国国家药品监督管理局的高效和对于乳腺癌耐药以后新一代治疗新药的期待和重视。同时,也凸显了来凯医药中美团队的强大执行力,有望使乳腺癌患者更早受益于新药。”来凯医药董事长兼CEO吕向阳博士表示,“在AKT酶抑制剂全球赛道上,来凯医药目前位于第一梯队。我们正在加速推进多项临床试验,希望afuresertib有实力摘下全球‘同类首个’(first-in-class)的金牌。”
[1] Li, Z.S., et al., Breast cancer subtypes and survival in chinese women with operable primary breast cancer. Chin J Cancer Res, 2011. 23(2): p. 134-9.
[2] SEER Cancer Stat Facts: Female Breast Cancer Subtypes. National Cancer Institute. Bethesda, MD. Available from: https://seer.cancer.gov/statfacts/html/breast-subtypes.html
关于afuresertib(LAE002)
Afuresertib(LAE002)是来凯医药从诺华公司获得全球独家产品授权,处于临床阶段的1类候选新药,属于新一代小分子泛AKT激酶强效抑制剂。它与来凯医药旗下的另一款候选药物 — 口服小分子泛AKT激酶抑制剂Uprosertib(LAE003)已经在包括卵巢癌、胃癌、多发性骨髓瘤、黑色素瘤等多种癌症适应症完成了20多项临床I/II期研究,其临床疗效和耐受安全性已得到初步临床验证(Proof-of-Concept)。Afuresertib(LAE002)正在全球展开两项II期和两项I期临床研究,其中针对卵巢癌的全球随机、开放、多中心 II 期注册临床研究(PROFECTA-II),是泛AKT激酶抑制剂在全球首个针对卵巢癌的注册临床研究。
AKT(一种丝氨酸/苏氨酸激酶)自被发现以来就成为医学界的关注热点,它在调控各种细胞功能(代谢、存活、增殖、组织侵袭、化疗抵抗等)方面发挥重要作用。PTEN缺失、AKT/PIK3CA突变或扩增等变化都会引起AKT信号通路的过度激活,是驱动肿瘤生长的关键途径之一,在复发性卵巢癌、乳腺癌和前列腺癌等肿瘤中AKT信号通路的失调尤为普遍。
关于来凯医药
作为活跃于中国“张江药谷”和美国新泽西的一家医药新锐公司,来凯医药科技(上海)有限公司成立于 2016 年 12 月,专注于肿瘤与肝病领域的突破性新药研发。
来凯医药采取“双线并举”的新药开发策略,一方面通过引进已经有临床验证(Proof of Concept)结果的新药项目持续丰富自身产品管线,目前公司已经获得诺华公司授予 4 项候选新药的全球独家授权;同时,公司自主开发的创新药也即将进入临床开发阶段。
公司汇聚全球高端制药人才和科技资源,核心团队成员均拥有超过 20 年中美两地新药开发的经验,具备从药物研发到上市的成功经验。秉持科学为本、创新为源的理念,来凯医药持续打造一流的药物临床研发管线,开发全球同类首个(First-in-Class)与同类最优(Best-in-Class)的创新药物,建立国际领先的新药研发平台,造福广大病患。
《软文网》https://www.rww.com.cn/是中国领先的软文推广, 发稿服务平台,助力中小企业网络营销与品牌传播。